Acide palmitique
| Acide palmitique | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
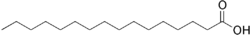
| structure de l'acide palmitique | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identification | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Nom UICPA | acide hexadécanoïque | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Synonymes | Acide n-hexadécanoïque | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| No CAS | 57-10-3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| No ECHA | 100.000.284 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| No CE | 200-312-9 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | 985 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ChEBI | 15756 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| FEMA | 2832 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SMILES | CCCCCCCCCCCCCCCC(=O)O PubChem, vue 3D | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| InChI | InChI : vue 3D InChI=1/C16H32O2/c1-2-3-4-5-6-7-8-9-10-11-12-13-14-15-16(17)18/h2-15H2,1H3,(H,17,18)/f/h17H | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apparence | cristaux incolores ou blancs[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés chimiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Formule | C16H32O2 [Isomères] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masse molaire[2] | 256,424 1 ± 0,015 6 g/mol C 74,94 %, H 12,58 %, O 12,48 %, | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés physiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T° fusion | 63 °C[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T° ébullition | 351 à 352 °C 215 °C (15 mmHg) 271,5 °C (100 mmHg) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Solubilité | dans l'eau : nulle[1],
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masse volumique | 0,852 7 g·cm-3 (62 °C)[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point d’éclair | 206 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pression de vapeur saturante | à 154 °C : 133 Pa[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermochimie | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cp | équation[4] :
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés optiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Indice de réfraction | 1,433 9 [3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Précautions | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Directive 67/548/EEC | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Xi Symboles : Xi : Irritant Phrases R : R36 : Irritant pour les yeux. Phrases S : S26 : En cas de contact avec les yeux, laver immédiatement et abondamment avec de l’eau et consulter un spécialiste. Phrases R : 36, Phrases S : 26, | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Écotoxicologie | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| DL50 | 57 ± 3,4 mg·kg-1 (souris, intra-veineuse) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LogP | 5,31[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Unités du SI et CNTP, sauf indication contraire. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
modifier  | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
L’acide palmitique (de palmitine avec le suffixe -ique) également appelé acide cétylique, acide hexadécanoïque (nom systématique) ou encore acide palmique, constitue l'un des acides gras saturés les plus courants chez les animaux et les plantes. On le symbolise souvent par les nombres 16:0 (soit la formule C16:0) pour indiquer qu'il a 16 carbones et aucune liaison éthylénique. Sa base conjuguée est l'ion palmitate qui forme des sels et des esters.
Propriétés
C'est un solide blanc qui fond à 63,1 °C et sa formule chimique est CH3(CH2)14COOH. Sa masse molaire est de 256 grammes par mole.
Quand il est fortement irradié (situation survenant fréquemment lors des procédures d'irradiation des aliments à des fins de désinfection et d'allongement des durées de conservation), il devient source de sous-produits de dégradation (radiolyse) présentant eux-mêmes des signes de toxicité cellulaire, les alkylcyclobutanones (ou 2-alkylcyclobutanones ou 2-ACB).
Production
Comme son nom l'indique, on en trouve dans l'huile de palme, mais aussi dans toutes les graisses et huiles animales (beurre, fromage, lait et viande) ou végétales.
L'acide palmitique est le premier acide gras produit au cours de la lipogenèse ; à partir de lui, les acides gras plus longs peuvent être produits.
De plus, il est l'acide gras utilisé préférentiellement pour synthétiser de l'ATP. Le bilan énergétique de sa combustion indique 129 ATP.
Utilisation
L'acide palmitique entre dans la composition de plusieurs huiles végétales alimentaires ainsi que dans des produits d'origine animale. Sa consommation augmenterait le risque de maladie cardiovasculaire[5].
Industriellement on utilise l'acide palmitique pour la fabrication des margarines, des savons durs. Pour un usage militaire, son sel, le palmitate de sodium est l'un des deux principaux composants du napalm (« palm » désignant palmitate et « na » le naphtalène).
Enfin, les esters d'acide palmitique sont également utilisés dans l'industrie pharmaceutique pour créer des médicaments retard (par exemple, palipéridone palmitate). Il peut également être utilisé dans la composition du Nutella (huile de palme), cela a cependant fait scandale en 2016.
Visualisation 3D
- JMOL
- MolUSc
- Protein Explorer
Rôle dans la peinture à l'huile
Étant donné qu'il est saturé, il ne peut pas polymériser et se rigidifier une fois en contact avec l'oxygène de l'air (à la différence des acides oléique, linoléique et linolénique). Il reste donc sous sa forme de solide mou et agit (avec l'acide stéarique) comme plastifiant des liants huileux polymérisés. Ainsi, avec l'acide stéarique, il assure l'élasticité nécessaire à la bonne conservation des matières picturale à l'huile, à travers le temps.
Recherche
Une méta-analyse de 2021 a montré que remplacer l'acide palmitique dans l'alimentation par des acides gras insaturés ou l'acide oléique réduit trois biomarqueurs de maladies cardiovasculaires et métaboliques : le LDL-cholestérol, le cholestérol total et apoB[6].
Notes et références
- ↑ a b c d et e ACIDE PALMITIQUE, Fiches internationales de sécurité chimique
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- ↑ a et b (en) J. G. Speight, Norbert Adolph Lange, Lange's handbook of chemistry, McGraw-Hill, , 16e éd., 1623 p. (ISBN 0-07-143220-5), p. 2.289
- ↑ (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 3, Huston, Texas, Gulf Pub. Co., (ISBN 0-88415-859-4)
- ↑ (en) Kabagambe E. K., « The Type of Oil Used for Cooking Is Associated with the Risk of Nonfatal Acute Myocardial Infarction in Costa Rica », The Journal of Nutrition, no 135, , p. 2674-2679 (lire en ligne)
- ↑ Laury Sellem, Matthieu Flourakis, Kim G. Jackson et Peter J. Joris, « Impact of Replacement of Individual Dietary SFAs on Circulating Lipids and Other Biomarkers of Cardiometabolic Health: A Systematic Review and Meta-Analysis of Randomized Controlled Trials in Humans », Advances in Nutrition (Bethesda, Md.), vol. 13, no 4, , p. 1200–1225 (ISSN 2156-5376, PMID 34849532, PMCID 9340975, DOI 10.1093/advances/nmab143, lire en ligne, consulté le )
Voir aussi
 Portail de la chimie
Portail de la chimie  Portail de la biochimie
Portail de la biochimie
















