Pentachlorure d'antimoine
| Pentachlorure d'antimoine | |||||
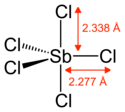 | |||||
| Structure du pentachlorure d'antimoine | |||||
| Identification | |||||
|---|---|---|---|---|---|
| Synonymes | chlorure d'antimoine(V) | ||||
| No CAS | 7647-18-9 | ||||
| No ECHA | 100.028.729 | ||||
| No CE | 231-601-8 | ||||
| No RTECS | CC5075000 | ||||
| PubChem | 24294 | ||||
| SMILES | Cl[Sb](Cl)(Cl)(Cl)Cl PubChem, vue 3D | ||||
| InChI | Std. InChI : vue 3D InChI=1S/5ClH.Sb/h5*1H;/q;;;;;+5/p-5 Std. InChIKey : VMPVEPPRYRXYNP-UHFFFAOYSA-I | ||||
| Apparence | liquide jaune à l'odeur âcre[1] | ||||
| Propriétés chimiques | |||||
| Formule | Cl5SbSbCl5 | ||||
| Masse molaire[2] | 299,025 ± 0,011 g/mol Cl 59,28 %, Sb 40,72 %, | ||||
| Propriétés physiques | |||||
| T° fusion | 3,5 °C[1] | ||||
| Solubilité | se décompose violemment au contact de l'eau[1] | ||||
| Masse volumique | 2,358 g·cm-3[1] à 16 °C | ||||
| Pression de vapeur saturante | 110 Pa[1] à 20 °C | ||||
| Précautions | |||||
| SGH[1] | |||||
  Danger H314 : Provoque de graves brûlures de la peau et des lésions oculaires H411 : Toxique pour les organismes aquatiques, entraîne des effets à long terme P273 : Éviter le rejet dans l’environnement. P280 : Porter des gants de protection/des vêtements de protection/un équipement de protection des yeux/du visage. P310 : Appeler immédiatement un CENTRE ANTIPOISON ou un médecin. P305+P351+P338 : En cas de contact avec les yeux : rincer avec précaution à l’eau pendant plusieurs minutes. Enlever les lentilles de contact si la victime en porte et si elles peuvent être facilement enlevées. Continuer à rincer. | |||||
| Transport[1] | |||||
Liquide :
Code Kemler : X80 : matière corrosive ou présentant un degré mineur de corrosivité réagissant dangereusement avec l'eau) Numéro ONU : 1730 : PENTACHLORURE D’ANTIMOINE LIQUIDE Classe : 8 Étiquette :  8 : Matières corrosives Emballage : Groupe d'emballage II : matières moyennement dangereuses ; Solution :
Code Kemler : 80 : matière corrosive ou présentant un degré mineur de corrosivité Numéro ONU : 1731 : PENTACHLORURE D’ANTIMOINE EN SOLUTION Classe : 8 Étiquette :  8 : Matières corrosives Emballage : Groupe d'emballage II/III : matières moyennement/faiblement dangereuses. | |||||
| Unités du SI et CNTP, sauf indication contraire. | |||||
modifier  | |||||
Le pentachlorure d'antimoine est un composé chimique de formule SbCl5. C'est un liquide incolore à l'odeur âcre, fumant au contact de l'air, généralement coloré en jaune par ses impuretés. Il s'agit d'une substance très oxydante[3] et très corrosive qui s'hydrolyse violemment en libérant de l'acide chlorhydrique au contact de l'eau. Il carbonise les matières plastiques non fluorées. Sa molécule à l'état gazeux présente une géométrie bipyramidale trigonale[4].
On obtient le pentachlorure d'antimoine en faisant passer du chlore Cl2 dans du trichlorure d'antimoine SbCl3 fondu :
- SbCl3 + Cl2 → SbCl5.
En présence de faibles quantités d'eau, le pentachlorure d'antimoine forme des hydrates : le monohydrate SbCl5·H2O et le tétrahydrate SbCl5·4H2O. En présence d'une plus grande quantité d'eau, il s'hydrolyse violemment en formant des oxychlorures d'antimoine comme l'acide antimonique (de) H3SbO4 avec libération d'acide chlorhydrique HCl :
- SbCl5 + 4 H2O → H3SbO4 (de) + 5 HCl.
Cette réaction disparaît en cas d'un large excès de chlorures en raison de la formation de complexes ioniques hexachloroantimonate [SbCl6]− :
- SbCl5 + Cl− → [SbCl6]−.
Ce composé forme des adduits avec de nombreuses bases de Lewis. Il est utilisé comme catalyseur de polymérisation et pour la chloration de composés organiques.
Notes et références
- ↑ a b c d e f et g Entrée « Antimony pentachloride » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 12 juin 2018 (JavaScript nécessaire)
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- ↑ (en) Neil G. Connelly et William E. Geiger*‡, « Chemical Redox Agents for Organometallic Chemistry », Chemical Reviews, vol. 96, no 2, , p. 877-910 (PMID 11848774, DOI 10.1021/cr940053x, lire en ligne)
- ↑ (en) Norman N. Greenwood et Alan Earnshaw, Chemistry of the Elements, 2e édition, Butterworth-Heinemann, 1997. (ISBN 0-08-037941-9)
v · m | |
|---|---|
| Antimoniures | |
| Sb(0) |
|
| Sb(III) |
|
| Sb(III,V) |
|
| Sb(V) |
|
v · m | |
|---|---|
| Chlorures Cl(-I) |
|
| Interhalogènes | |
| Composés BCl4, AuCl4 |
|
| Composés AlCl6, PCl6... |
|
| Composés NbCl7, TaCl7 |
|
| Perchlorocarbures |
|
| Hydrocarbures halogénés |
|
| Oxohalogénures | |
 Portail de la chimie
Portail de la chimie










