Chlorure de béryllium
| Chlorure de Béryllium | |||
 | |||
| Identification | |||
|---|---|---|---|
| Nom UICPA | chlorure de béryllium | ||
| No CAS | 7787-47-5 | ||
| No ECHA | 100.029.197 | ||
| No CE | 232-116-4 | ||
| PubChem | 24588 | ||
| SMILES | [Be+2].[Cl-].[Cl-] PubChem, vue 3D | ||
| InChI | InChI : vue 3D InChI=1S/Be.2ClH/h;2*1H/q+2;;/p-2 | ||
| Apparence | Cristaux incolores à jaunes | ||
| Propriétés chimiques | |||
| Formule | BeCl2 [Isomères] | ||
| Masse molaire[1] | 79,918 ± 0,004 g/mol Be 11,28 %, Cl 88,72 %, | ||
| Propriétés physiques | |||
| T° fusion | 416 °C [2] | ||
| T° ébullition | 520 °C [2] | ||
| Solubilité | 151 g·l-1 | ||
| Masse volumique | 1,9 g·cm-3 à 20 °C [3] | ||
| Thermochimie | |||
| S0gaz, 1 bar | 252,13 J·K-1·mol-1 [4] | ||
| S0liquide, 1 bar | 79,71 J·K-1·mol-1 [4] | ||
| ΔfH0gaz | −360,24 kJ·mol-1 [4] | ||
| ΔfH0liquide | −491,31 kJ·mol-1 [4] | ||
| ΔfH0solide | −496,22 kJ·mol-1 [4] | ||
| ΔvapH° | 105 kJ·mol-1 (1 atm, 482 °C)[5] | ||
| Précautions | |||
| SGH[3] | |||
   Danger H301 : Toxique en cas d'ingestion H315 : Provoque une irritation cutanée H317 : Peut provoquer une allergie cutanée H319 : Provoque une sévère irritation des yeux H330 : Mortel par inhalation H335 : Peut irriter les voies respiratoires H350i : Peut provoquer le cancer par inhalation. H372 : Risque avéré d'effets graves pour les organes (indiquer tous les organes affectés, s'ils sont connus) à la suite d'expositions répétées ou d'une exposition prolongée (indiquer la voie d'exposition s'il est formellement prouvé qu'aucune autre voie d'exposition ne conduit au même danger) H411 : Toxique pour les organismes aquatiques, entraîne des effets à long terme | |||
| Transport[3] | |||
Code Kemler : 60 : matière toxique ou présentant un degré mineur de toxicité Numéro ONU : 1566 : COMPOSÉ DU BÉRYLLIUM, N.S.A. Classe : 6.1 Étiquette :  6.1 : Matières toxiques Emballage : Groupe d'emballage II/III : matières moyennement/faiblement dangereuses. | |||
| Inhalation | Toux. Mal de gorge. Essoufflement. Symptômes d'effets retardés. | ||
| Peau | Rougeur. Douleur. | ||
| Yeux | Rougeur. Douleur. Troubles de la vue. | ||
| Ingestion | Nausées. Vomissements. Douleurs abdominales. | ||
| Écotoxicologie | |||
| DL50 | 92 mg·kg-1 (souris, oral) 11,987 mg·kg-1 (souris, i.p.) 86 mg·kg-1 (rat, oral) 5,32 mg·kg-1 (rat, i.p.) [6] | ||
| Composés apparentés | |||
| Autres cations | Chlorure de magnésium Chlorure de calcium Chlorure de strontium Chlorure de baryum | ||
| Autres anions | Fluorure de béryllium Bromure de béryllium Iodure de béryllium | ||
| Unités du SI et CNTP, sauf indication contraire. | |||
modifier  | |||
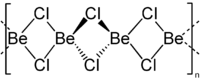
Le chlorure de béryllium est un composé chimique de formule brute BeCl2. C'est un acide de Lewis utilisé comme catalyseur.
Utilisation
Le chlorure de béryllium est un précurseur dans la synthèse de composés organiques contenant du béryllium et une source pour la production de béryllium[2].
Propriétés physico-chimiques
Le chlorure de béryllium réagit de manière très exothermique avec l'eau en produisant du chlorure d'hydrogène[2]. C'est un produit très hygroscopique et il forme par contact avec de l'air humide un complexe tétravalent.
Production et synthèse
Le chlorure de béryllium peut être produit par chloration de l'oxyde de béryllium dans des conditions réductrices. La chloration du minerai est une étape de purification du métal[2].
Un mélange de béryl (un aluminosilicate naturel de béryllium) et de carbone sont chauffés à 800 °C en présence de dichlore ou alors fondus dans un four à arc électrique où ils forment du carbure de béryllium avant d'être chlorés. La réaction peut avoir lieu en présence de gaz chlorés tels le chlorure d'hydrogène, le tétrachlorure de carbone, le chlorure de soufre ou le phosgène. Les composés chlorés volatils sont ensuite séparés par condensation fractionnée ou par extraction liquide-liquide dans du chlorure de soufre, du trichlorure de phosphore, du chlorure de bore ou encore du phosgène[2].
La distillation dans un flux d'hydrogène permet de séparer facilement le chlorure de béryllium d'autres chlorures tels le chlorure de fer, le chlorure d'aluminium ou le chlorure de silicium[2]. Le chlorure de béryllium est ensuite utilisé pour obtenir le béryllium par réduction en présence de sodium en phase gazeuse à 250 °C. Ce procédé est toutefois mineur et le métal est produit de manière industrielle par électrolyse[2].
Notes et références
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- ↑ a b c d e f g et h (en) Günter Petzow, Fritz Aldinger, Sigurd Jönsson, Peter Welge, Vera van Kampen, Thomas Mensing, Thomas Brüning, Beryllium and Beryllium Compounds, Wiley-VCH Verlag GmbH & Co., coll. « Ullmann's Encyclopedia of Industrial Chemistry »,
- ↑ a b c et d Entrée « Beryllium chloride » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 26 janvier 2010 (JavaScript nécessaire)
- ↑ a b c d et e (en) « Beryllium dichloride », sur NIST/WebBook, consulté le
- ↑ (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press Inc, , 90e éd., 2804 p., Relié (ISBN 978-1-4200-9084-0)
- ↑ (en) « Chlorure de béryllium », sur ChemIDplus, consulté le
v · m | |
|---|---|
v · m | |
|---|---|
| Chlorures Cl(-I) |
|
| Interhalogènes | |
| Composés BCl4, AuCl4 |
|
| Composés AlCl6, PCl6... |
|
| Composés NbCl7, TaCl7 |
|
| Perchlorocarbures |
|
| Hydrocarbures halogénés |
|
| Oxohalogénures | |
 Portail de la chimie
Portail de la chimie










