Trimer (hemija)
U hemiji, trimer je molekul ili poliatomski anjon nastao kombinacijom ili asocijacijom tri molekula ili jona iste supstance. U tehničkom žargonu, trimer je vrsta oligomera dobijenog od tri identična prekurzora često u konkurenciji sa polimerizacijom.
Primeri
Alkinska trimerizacija

Godine 1866, Marcelin Bertelo je izvestio o prvom primeru ciklotrimerizacije, pretvaranja acetilena u benzen.[1] Ovaj proces je komercijalizovan:
Trimerizacija nitrila
Simetrični 1,3,5-triazini se dobijaju trimerizacijom određenih nitrila kao što je cijanogen hlorid.
Cijanogen hlorid i cijanogen bromid se trimerizuju na povišenim temperaturama preko ugljeničnog katalizatora.[1] Hlorid daje cijanurični hlorid:
Bromid ima produženi rok trajanja kada se čuva u frižideru. Kao i hlorid, on se podvrgava ab egzotermnoj trimerizaciji da bi se formirao cijanurični bromid. Ovu reakciju katalizuju tragovi broma, metalnih soli, kiselina i baza.[2] Iz tog razloga, eksperimentatori izbegavaju braonaste uzorke.[3]
Industrijski put do cijanurske kiseline podrazumeva termičko razlaganje uree, uz oslobađanje amonijaka. Konverzija počinje na približno 175 °C:[4]
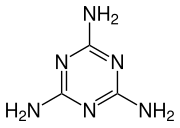
Endotermna sinteza melamina može se razumeti u dva koraka.
Prvo, urea se razlaže na izocijansku kiselinu i amonijak u endotermnoj reakciji:
Zatim u drugom koraku, izocijanska kiselina se polimerizuje da bi se formirala cijanurska kiselina, koja se kondenzuje sa oslobođenim amonijakom iz prvog koraka da bi oslobodio melamin i voda.
Ova voda zatim reaguje sa prisutnom izocijanskom kiselinom, koja pomaže u pokretanju reakcije trimerizacije, stvarajući ugljen-dioksid i amonijak.
Drugi korak je egzoterman:
ali je ukupan proces endoterman.
Dienska trimerizacija
1,5,9-trans-trans-cis izomer ciklododekatriena, koji ima određeni industrijski značaj, dobija se ciklotrimerizacijom butadiena sa titanijum tetrahloridom i organoaluminijumskim kokatalizatorom:[5]
Razlaganje ugljenik-hetero dvostrukih veza uz formiranje simetričnih zasićenih 1,3,5-heterocikličnih jedinjenja
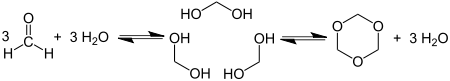
Ciklotrimerizacija formaldehida daje 1,3,5-trioksan:
1,3,5-tritian je ciklični trimer inače nestabilne vrste tioformaldehida. Ovo heterociklično jedinjenje se sastoji od šestočlanog prstena sa naizmeničnim metilenskim mostovima i tioetarskim grupama. Priprema se tretiranjem formaldehida vodonik-sulfidom.[6]
Tri molekula acetaldehida se kondenzuju i formiraju paraldehid, ciklični trimer koji sadrži C-O jednostruke veze.
Katalizacija i dehidratacija sumpornom kiselinom, trimerizacija acetona preko aldolne kondenzacije daje mezitilen[7]
Trisiloksani
Dimetilsilandiol dehidrira do trimera Me
2SiO kao i polidimetilsiloksan. Reakcija ilustruje konkurenciju između trimerizacije i polimerizacije. Polimer i trimer su formalno izvedeni iz hipotetičkog sila-ketona Me
2Si=O, iako ova vrsta nije intermedijer.
Koordinaciona hemija

2CPh)
2]
3.
Ditiobenzoatni kompleksi [M(S
2CPh)
2] kristališu kao trimeri (M = Ni, Pd).[8]
Vidi još
Reference
- ^ а б Hillis O. Folkins (2005). „Benzene”. Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. ISBN 3527306730. doi:10.1002/14356007.a03_475.
- ^ Morris, Joel; Kovács, Lajos; Ohe, Kouichi (2015). „Cyanogen Bromide”. Encyclopedia of Reagents for Organic Synthesis. стр. 1—8. ISBN 9780470842898. doi:10.1002/047084289X.rc269.pub3.
- ^ Joel Morris; Lajos Kovács (2008). „Cyanogen Bromide”. Encyclopedia of Reagents for Organic Synthesis. ISBN 978-0471936237. doi:10.1002/047084289X.rc269.pub2.
- ^ Klaus Huthmacher, Dieter Most "Cyanuric Acid and Cyanuric Chloride" Ullmann's Encyclopedia of Industrial Chemistry" 2005, Wiley-VCH, Weinheim. doi 10.1002/14356007.a08 191
- ^ Industrial Organic Chemistry, Klaus Weissermel, Hans-Jurgen Arpe John Wiley & Sons; 3rd 1997 ISBN 3-527-28838-4
- ^ Bost, R. W.; Constable, E. W. "sym-Trithiane" Organic Syntheses, Collected Volume 2, p.610 (1943). „Archived copy” (PDF). Архивирано из оригинала (PDF) 2012-03-29. г. Приступљено 2014-05-05.
- ^ Cumming, W. M. (1937). Systematic organic chemistry (3E). New York, USA: D. Van Nostrand Company. стр. 57.
- ^ Bonamico, M.; Dessy, G.; Fares, V.; Scaramuzza, L. (1975). „Structural Studies of Metal Complexes with Sulphur-Containing Bidentate Ligands. Part I. Crystal and Molecular Structures of Trimeric Bis-(dithiobenzoato)-nickel(II) and -palladium(II)”. Journal of the Chemical Society, Dalton Transactions (21): 2250—2255. doi:10.1039/DT9750002250.
Spoljašnje veze




![{\displaystyle {\ce {3 H2N-CO-NH2 -> [C(O)NH]3 + 3 NH3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6de156d81639cf3dcee9ba7233f13135ba2bfa91)

![{\displaystyle {\ce {3 HOCN -> [C(O)NH]3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e6a34f3b03c3ba201baf55fca465c07bf72526c7)
![{\displaystyle {\ce {[C(O)NH]3 + 3 NH3 -> C3H6N6 + 3 H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/622a370fe2c00b97f4012e0e3294ddc0741bcc0f)