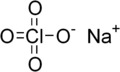Nadchloran sodu
| |||||||||||||||||||||||||||||||||
 | |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||
| Wzór sumaryczny | NaClO | ||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa | 122,44 g/mol | ||||||||||||||||||||||||||||||||
| Wygląd | białe, higroskopijne, krystaliczne ciało stałe | ||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||
| Numer CAS | 7601-89-0 | ||||||||||||||||||||||||||||||||
| PubChem | 522606 | ||||||||||||||||||||||||||||||||
| DrugBank | DBDB16608 | ||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||
| Inne aniony | NaClO, NaClO | ||||||||||||||||||||||||||||||||
| Inne kationy | LiClO | ||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
Nadchloran sodu, NaClO
4 – nieorganiczny związek chemiczny, sól sodowa kwasu nadchlorowego.
Właściwości
Nadchloran sodu jest najlepiej rozpuszczalną solą z nadchloranów. Jest białą, higroskopijną, krystaliczną substancją stałą. Zazwyczaj występuje jako monohydrat o rombowym układzie krystalograficznym[1].
Otrzymywanie
Związek jest otrzymywany w reakcji anodowego utleniania chloranu sodu na anodzie wykonanej z platyny, β-tlenku ołowiu(II) lub grafitu. Katoda jest wykonana ze stali[5].
Schematyczny przebieg reakcji jest następujący:
- NaClO
3 + H
2O → NaClO
4 + H
2↑
Ponadto jako produkt uboczny na anodach wydziela się tlen. W zależności od używanych anod wymagane jest napięcie prądu 4,75 V (anoda z tlenku ołowiu) lub 6 V (anoda platynowa). Zużycie energii dla procesu wynosi 2,5–3 kWh/kg nadchloranu sodu[5].
Zastosowanie
W laboratorium stosowany jest jako prekursor w syntezie innych nadchloranów. Z powodu jego higroskopijności znajduje niewielkie zastosowanie w pirotechnice. W napędach rakietowych może służyć jako źródło tlenu.
Przypisy
- ↑ a b c d e David R.D.R. Lide David R.D.R. (red.), CRC Handbook of Chemistry and Physics, wyd. 90, Boca Raton: CRC Press, 2009, s. 4-91, ISBN 978-1-4200-9084-0 (ang.).
- ↑ sodium perchlorate, [w:] Classification and Labelling Inventory, Europejska Agencja Chemikaliów [dostęp 2015-03-28] (ang.).
- ↑ Sodium perchlorate (nr 410241) – karta charakterystyki produktu Sigma-Aldrich (Merck) na obszar Polski. [dostęp 2011-07-30]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ Sodium perchlorate (nr 410241) (ang.) – karta charakterystyki produktu Sigma-Aldrich (Merck) na obszar Stanów Zjednoczonych. [dostęp 2011-07-30]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ a b Karl HeinzK.H. Büchel Karl HeinzK.H., Hans-HeinrichH.H. Moretto Hans-HeinrichH.H., Industrial Inorganic Chemistry, Weinheim–New York: Wiley-VCH, 2000, s. 172, DOI: 10.1002/9783527613328, ISBN 978-3-527-29849-5 (ang.).
- SNL: natriumperklorat