Styrène
| Styrène | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identification | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Synonymes | Phényléthylène | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| No CAS | 100-42-5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| No ECHA | 100.002.592 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| No CE | 202-851-5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| No RTECS | WL3675000 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | 7501 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ChEBI | 27452 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| FEMA | 3233 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SMILES | C=CC1=CC=CC=C1 PubChem, vue 3D | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| InChI | InChI : vue 3D InChI=1S/C8H8/c1-2-8-6-4-3-5-7-8/h2-7H,1H2 InChIKey : PPBRXRYQALVLMV-UHFFFAOYSA-N | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apparence | liquide huileux, incolore à jaune[1]. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés chimiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Formule | C8H8 [Isomères] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masse molaire[5] | 104,149 1 ± 0,007 g/mol C 92,26 %, H 7,74 %, | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Moment dipolaire | 0,123 ± 0,003 D[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Susceptibilité magnétique | 68,2×10-6 cm3·mol-1[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Diamètre moléculaire | 0,593 nm[4] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés physiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T° fusion | −30,6 °C[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T° ébullition | 145,14 °C[6] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Solubilité | dans l'eau à 25 °C : 0,3 g l−1[1], dans l'éthanol, les éthers, l'acétone[7] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Paramètre de solubilité δ | 19,0 MPa1/2 (25 °C)[8] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscibilité | dans le benzène | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
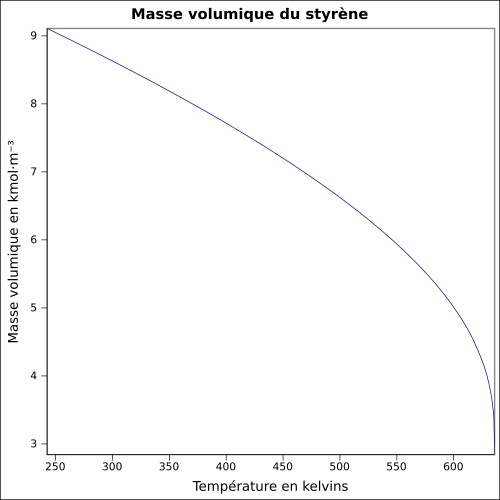
| Masse volumique | 0,906 0 g cm−3[9] équation[10] :
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T° d'auto-inflammation | 490 °C[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point d’éclair | 31 °C (coupelle fermée)[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Limites d’explosivité dans l’air | 0,9–6,8 %vol[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pression de vapeur saturante | à 20 °C : 0,7 kPa[1] équation[10] :
 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point critique | 40,0 bar, 367,65 °C[11] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermochimie | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
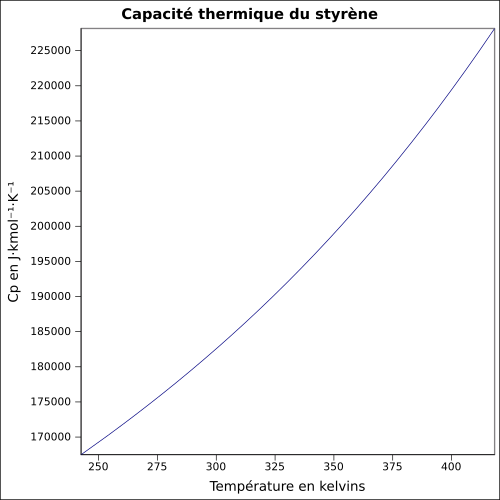
| Cp | équation[10] :
équation[12] :
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cristallographie | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Classe cristalline ou groupe d’espace | Pbcn[13] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Paramètres de maille | a = 15,690 Å b = 10,585 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Volume | 1 257,99 Å3[13] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés optiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Indice de réfraction | 1,5440[4] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Précautions | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SGH[15] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
   Danger H226 : Liquide et vapeurs inflammables H315 : Provoque une irritation cutanée H319 : Provoque une sévère irritation des yeux H332 : Nocif par inhalation H361d : Susceptible de nuire au fœtus. H372 : Risque avéré d'effets graves pour les organes (indiquer tous les organes affectés, s'ils sont connus) à la suite d'expositions répétées ou d'une exposition prolongée (indiquer la voie d'exposition s'il est formellement prouvé qu'aucune autre voie d'exposition ne conduit au même danger) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SIMDUT[16] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
  B2, D2A, D2B, B2 : Liquide inflammable point d'éclair =31 °C coupelle fermée (méthode non rapportée) D2A : Matière très toxique ayant d'autres effets toxiques cancérogénicité : CIRC groupe 2B D2B : Matière toxique ayant d'autres effets toxiques irritation des yeux chez l'animal Divulgation à 0,1 % selon la liste de divulgation des ingrédients | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NFPA 704 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
3 2 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Transport | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Code Kemler : 39 : liquide inflammable, pouvant produire spontanément une réaction violente Numéro ONU : 2055 : STYRÈNE MONOMÈRE STABILISÉ Classe : 3 Code de classification : F1 : Matières solides inflammables, sans danger subsidiaire, organiques ; Étiquette :  3 : Liquides inflammables Emballage : Groupe d'emballage III : matières faiblement dangereuses. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Classification du CIRC | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Groupe 2B : Peut-être cancérogène pour l'homme[14] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Inhalation | vertige, somnolence, nausée, faiblesse | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Peau | rougeur | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Yeux | rougeur, douleur | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Écotoxicologie | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LogP | 3,2[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| DJA | 0,12 mg/kg p.c. par jour[17] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Seuil de l’odorat | bas : 0,01 ppm haut : 1,9 ppm[18] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Unités du SI et CNTP, sauf indication contraire. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
modifier  | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Le styrène est un composé organique aromatique de formule chimique C8H8. C'est un liquide à température et à pression ambiantes. Il est utilisé pour fabriquer des plastiques, en particulier le polystyrène. Le styrène est un composé incolore, huileux, toxique et inflammable. Il est naturellement présent en faibles quantités dans certaines plantes, et est produit industriellement à partir du pétrole. De faibles concentrations de styrène sont également présentes dans les fruits, les légumes et la viande. Le styrène est aussi présent dans la fumée de cigarette[19].
Histoire
Autour de 1835, le pharmacien berlinois Eduard Simon acquiert du styrax, une résine également appelée « ambre liquide » issue du Liquidambar orientalis, un arbre poussant au Proche-Orient. Cette résine a subi des traitements et a été mélangée, notamment à du parfum. En distillant cette résine, Simon obtient un liquide incolore qu'il baptise styrène en référence au nom de la résine. En chauffant ce liquide, il obtient une nouvelle substance, qu'il suppose être de l'oxyde de styrène. Cependant, les chimistes britanniques John Blyth et August Wilhelm von Hofmann découvrent en 1845 par analyse élémentaire que la composition de la matière n'a pas changé au cours de la transformation. Il faut attendre 1866 pour que Marcellin Berthelot fournisse une interprétation correcte du phénomène : il s'agit d'une réaction de polymérisation. Hermann Staudinger, dont les travaux concernèrent principalement la chimie des polymères, écrit dans sa thèse que le chauffage du liquide entraîne une réaction en chaîne qui se traduit par l'apparition de macromolécules de polystyrène.
Le styrène est au centre d'un documentaire de 19 minutes réalisé en 1958 par Alain Resnais : Le Chant du styrène. Le dialogue de Raymond Queneau qui est mis en valeur par la voix chaude et profonde de Pierre Dux, décrit ainsi cette réaction :
Le styrène est produit majoritairement par la déshydrogénation de l'éthylbenzène surchauffé. La réaction nécessite un catalyseur tel que de l'oxyde de fer. Le styrène autrefois s'extrayait du benjoin, provenant du styrax, arbuste indonésien.
Propriétés physico-chimiques
Le styrène possède une odeur agréable à faibles concentrations, mais rapidement insupportable si la concentration augmente. L'odeur est détectable entre 0,43 et 866 mg/m3. Le styrène possède des propriétés lacrymogène dès que la concentration dépasse 10 mg/m3. Il est peu soluble dans l'eau, mais il possède une bonne solubilité dans l'acétone, l'éther, le disulfure de carbone et les alcools. Le styrène s'évapore facilement. La molécule de styrène possédant un groupement vinyle, et donc une double liaison carbone-carbone, elle peut polymériser. Le styrène liquide commence à polymériser à la température ambiante en formant un liquide jaune visqueux. Il peut être stabilisé par l'ajout de 50 ppm d'hydroquinone. Cependant, la stabilisation n'est possible qu'en présence de faibles quantités d'oxygène. La polymérisation est très nettement accélérée par la lumière. Le styrène doit être stocké au frais dans des récipients opaques.
Réactions chimiques
Le comportement chimique du styrène est similaire à celui du benzène, le styrène étant toutefois plus réactif. Il réagit principalement au cours de réactions de type substitution radicalaire, de substitution électrophile aromatique (par exemple la sulfonation ou la nitration) ainsi que d'addition radicalaire. Les réactions de type substitution nucléophile sont nettement moins fréquentes. Il s'oxyde en oxyde de styrène.
Le comportement du styrène vis-à-vis des réactions de polymérisation est assez inhabituel : il peut subir des polymérisations de type radicalaire, tout comme des polymérisations anioniques ou cationiques. Il peut ainsi copolymériser avec du chlorure de fer par polymérisation cationique. Le styrène seul polymérise par un mécanisme radicalaire pour former le polystyrène. Cette dernière réaction est initiée plus facilement en présence d'un catalyseur (plus exactement un initiateur dans le cas du polystyrène), de type peroxyde la plupart du temps.
Production
Avant 1930, date à laquelle des procédés de fabrication du styrène commencent à être développés, il est obtenu par séparation lors du raffinage du pétrole.
Il existe principalement deux procédés de fabrication du styrène à l'échelle industrielle. Le premier est un procédé de type déshydrogénation catalytique. Le styrène est fabriqué par chauffage vers 600 à 650 °C d'éthylbenzène (EB) en présence d'un catalyseur, généralement de l'oxyde de magnesium ou de l'oxyde de zinc. La réaction chimique est réversible (c'est un équilibre chimique) et endothermique. Le rendement est augmenté en travaillant sous pression réduite.
Le second procédé, moins utilisé, s'effectue en plusieurs étapes. L'éthylbenzène est d'abord oxydé à 150 °C sous une pression de 2 bar. Le produit formé (un peroxyde) réagit ensuite avec du propène à 115 °C sous pression élevée et en présence de dioxyde de silicium pour former de l'α-phényléthanol. Ce dernier subit ensuite une déshydratation à 200 °C environ, en présence d'alumine pour former le styrène.
En 1996, la production mondiale de styrène était d'environ 20 millions de tonnes.
Utilisation
Le styrène est utilisé comme monomère pour fabriquer des plastiques. Le plus important est le polystyrène (le styrène est le seul monomère).
De nombreux autres sont produits par copolymérisation (utilisation de plusieurs monomères), notamment l'acrylonitrile butadiène styrène (ABS), le caoutchouc ou le latex à base de styrène-butadiène (SBS), le styrène-acrylonitrile (SAN), l'acrylonitrile styrène acrylate (ASA) ainsi que des polyesters insaturés. La production de styrène a notamment augmenté très rapidement aux États-Unis durant la Seconde Guerre mondiale pour répondre aux besoins de caoutchouc synthétique pour l'armée. Le styrène est également utilisé en faibles quantités comme additif dans des parfums ou des médicaments. C'est également un solvant, utilisé notamment pour la synthèse de résines polyester.
Effets sur la santé
L'inhalation de concentrations élevées de styrène peut occasionner des troubles du système nerveux, tels que de la dépression ou des difficultés de concentration, de la faiblesse musculaire, des nausées ainsi qu'une irritation des yeux, du nez et de la gorge.
Des études sur des animaux ont révélé que la respiration de vapeurs de styrène pendant de courtes durées entraîne un endommagement des cloisons nasales. Une exposition plus longue occasionne des dégâts au foie. Aucune donnée n'est disponible concernant l'effet sur la santé humaine de la présence de faibles concentrations de styrène dans l'air respiré pendant de longues périodes.
Il n'y a également que peu de données sur les effets sur la santé humaine d'une exposition au styrène par ingestion ou contact avec la peau. Les études sur des animaux ont montré que l'ingestion de concentrations élevées de styrène sur plusieurs semaines occasionnent des dommages au foie, aux reins, au cerveau et aux poumons. Le contact direct sur la peau de lapins entraîne une irritation.
Les études sur des animaux ont également montré un effet négatif de l'exposition à de très hauts taux de styrène pendant de courtes périodes sur la reproduction et le développement du fœtus. Aucune donnée n'est disponible pour l'humain.
D'après le Centre international de recherche sur le cancer, le styrène pourrait être cancérogène pour l'humain. Plusieurs études effectuées sur une population de salariés exposés au styrène ont mis en évidence un risque de leucémie. Des études sur des animaux ont montré que le styrène est faiblement cancérogène par inhalation ou ingestion. En , le National Institutes of Health a classé le styrène dans la liste des molécules cancérigènes chimiques et biologiques[20].
Les propriétés neurotoxiques[21] du styrène ne se limitent pas à des effets sur le système nerveux central, mais provoquent également des effets néfastes sur la vision[22],[23] et sur la fonction auditive[24],[25],[26],[27]. Des études sur des animaux de laboratoire[25],[26] ainsi que des études épidémiologiques[28],[29], ont mis en évidence une interaction synergique avec le bruit pouvant entraîner des troubles de l'audition supérieurs à ceux engendrés par les deux nuisances de manière indépendante.
L’étiquetage du styrène comporte une mention « ototoxique » (Classement CLP H372 : « Risque avéré d'effets graves pour les organes (appareil auditif) »[30].
Effets sur l'environnement
Sur l'échelle du MARPOL, le styrène a une toxicité Y, c'est-à-dire qu'il est toxique mais peu persistant dans l'environnement. Il persiste dans un milieu marin pendant quelques jours, et est peu bioaccumulable. En revanche, en faible dose, le styrène peut induire une modification de couleur ou de goût des aliments marins[31].
Phrases de risque et conseils de prudence
Étiquetage selon le règlement (CE) 1272/2008 :
- Flam. Liq. 3 (liquide inflammable) ;
- Skin Irrit. 2 (irritant pour la peau) ;
- Eye Irrit. 2 (irritant pour les yeux) ;
- Acute Tox. 4 (toxique par inhalation) ;
- STOT RE 1 (dangereux pour les organes cibles - exposition répétée - appareil auditif) ;
- Repr. 2 (Susceptible de nuire au fœtus).
Étiquetage précédent :
- R: 10 (Inflammable) ;
- R: 20 (Nocif par inhalation) ;
- R: 36/38 (Irritant pour les yeux et la peau) ;
- S: 2 (Conserver hors de la portée des enfants) ;
- S: 23 (Ne pas respirer les gaz/fumées/vapeurs/aérosols (terme(s) approprié(s) à indiquer par le fabricant)).
Notes et références
- ↑ a b c d e f g et h STYRENE, Fiches internationales de sécurité chimique
- ↑ (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1 et 1-4200-6679-X), p. 9-50.
- ↑ (en) Hyp J. Dauben, Jr., James D. Wilson et John L. Laity, « Diamagnetic Susceptibility Exaltation in Hydrocarbons », Journal of the American Chemical Society, vol. 91, no 8, , p. 1991-1998.
- ↑ a et b (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, England, John Wiley & Sons Ltd, , 239 p. (ISBN 0-471-98369-1).
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- ↑ (en) Iwona Owczarek et Krystyna Blazej, « Recommended Critical Temperatures. Part II. Aromatic and Cyclic Hydrocarbons », J. Phys. Chem. Ref. Data, vol. 33, no 2, , p. 541 (DOI 10.1063/1.1647147).
- ↑ (en) William M. Haynes, CRC Handbook of Chemistry and Physics, CRC Press, 2014-2015, 95e éd., 2666 p. (ISBN 978-1-4822-08672), p. 631.
- ↑ (en) James E. Mark, Physical Properties of Polymer Handbook, Springer, , 2e éd., 1076 p. (ISBN 978-0-387-69002-5 et 0-387-69002-6, lire en ligne), p. 294
- ↑ (en) J. G. Speight et Norbert Adolph Lange, Lange's handbook of chemistry, McGraw-Hill, , 16e éd., 1623 p. (ISBN 0-07-143220-5), p. 2.289.
- ↑ a b et c (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, États-Unis, McGraw-Hill, , 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50.
- ↑ « Properties of Various Gases », sur flexwareinc.com (consulté le ).
- ↑ (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams : Organic Compounds C8 to C28, vol. 3, Huston, Texas, Gulf Pub. Co., , 396 p. (ISBN 0-88415-859-4).
- ↑ a b et c « Styrene », sur reciprocalnet.org (consulté le ).
- ↑ IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Évaluations Globales de la Cancérogénicité pour l'Homme, Groupe 2B : Peut-être cancérogènes pour l'homme », sur monographs.iarc.fr, CIRC, (consulté le ).
- ↑ Numéro index 601-026-00-0 dans le tableau 3.1 de l'annexe VI du règlement CE no 1272/2008 (16 décembre 2008).
- ↑ « Styrène » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ Concentrations/doses journalières admissibles et concentrations/doses tumorigènes des substances d'intérêt prioritaire calculées en fonction de critères sanitaires, publié par Santé Canada
- ↑ « Styrene », sur hazmap.nlm.nih.gov (consulté le ).
- ↑ « Liste des composants d'une cigarette - Stop la clope », Stop la clope, (lire en ligne, consulté le )
- ↑ (en) National Institutes of Health, « New substances added to HHS Report on Carcinogens », .
- ↑ N. Cherry et D. Gautrin, « Neurotoxic effects of styrene: further evidence », British Journal of Industrial Medicine, vol. 47, no 1, , p. 29–37 (ISSN 0007-1072, PMID 2155647, PMCID PMC1035091, lire en ligne, consulté le )
- ↑ K. Murata, S. Araki et K. Yokoyama, « Assessment of the peripheral, central, and autonomic nervous system function in styrene workers », American Journal of Industrial Medicine, vol. 20, no 6, , p. 775–784 (ISSN 0271-3586, PMID 1666820, lire en ligne, consulté le )
- ↑ Andreas Seeber, Thomas Bruckner et Gerhard Triebig, « Occupational styrene exposure, colour vision and contrast sensitivity: a cohort study with repeated measurements », International Archives of Occupational and Environmental Health, vol. 82, no 6, , p. 757–770 (ISSN 1432-1246, PMID 19330514, DOI 10.1007/s00420-009-0416-7, lire en ligne, consulté le )
- ↑ Pierre Campo, Thomas Venet, Cécile Rumeau et Aurélie Thomas, « Impact of noise or styrene exposure on the kinetics of presbycusis », Hearing Research, vol. 280, nos 1-2, , p. 122–132 (ISSN 1878-5891, PMID 21616132, DOI 10.1016/j.heares.2011.04.016, lire en ligne, consulté le )
- ↑ a et b R. Lataye, P. Campo, G. Loquet et G. Morel, « Combined effects of noise and styrene on hearing: comparison between active and sedentary rats », Noise & Health, vol. 7, no 27, , p. 49–64 (ISSN 1463-1741, PMID 16105249, lire en ligne, consulté le )
- ↑ a et b Pierre Campo, Thomas Venet, Aurélie Thomas et Chantal Cour, « Neuropharmacological and cochleotoxic effects of styrene. Consequences on noise exposures », Neurotoxicology and Teratology, vol. 44, , p. 113–120 (ISSN 1872-9738, PMID 24929234, DOI 10.1016/j.ntt.2014.05.009, lire en ligne, consulté le )
- ↑ Johnson, Ann-Christin, The Nordic Expert Group for criteria documentation of health risks from chemicals. 142, Occupational exposure to chemicals and hearing impairment, University of Gothenburg, (ISBN 978-91-85971-21-3 et 9185971219, OCLC 939229378, lire en ligne)
- ↑ Mariola Sliwińska-Kowalska, Ewa Zamyslowska-Szmytke, Wieslaw Szymczak et Piotr Kotylo, « Ototoxic effects of occupational exposure to styrene and co-exposure to styrene and noise », Journal of Occupational and Environmental Medicine, vol. 45, no 1, , p. 15–24 (ISSN 1076-2752, PMID 12553175, lire en ligne, consulté le )
- ↑ Thais C. Morata, Mariola Sliwinska-Kowalska, Ann-Christin Johnson et Jukka Starck, « A multicenter study on the audiometric findings of styrene-exposed workers », International Journal of Audiology, vol. 50, no 10, , p. 652–660 (ISSN 1708-8186, PMID 21812635, DOI 10.3109/14992027.2011.588965, lire en ligne, consulté le )
- ↑ « Styrène (FT 2). Généralités - Fiche toxicologique - INRS », sur inrs.fr (consulté le ).
- ↑ Propriétés du styrène.
Bibliographie
- Styrol (Ethenylbenzol), Wiley/VCH, Weinh, 1990 (ISBN 3-527-28255-6).
- Frank-Dieter Kuchta, Thermische und laserinduzierte radikalische Polymerisationen von Styrol bis zu hohen Drücken, Temperaturen und Umsätzen, Cuvillier, 1995 (ISBN 3-89588-468-5).
- Petra Schneider, Photoinitiierte Polymerisation von Styrol in festem Paraffin, Shaker Verlag, 1996 (ISBN 3-8265-1521-8).
- Peter Quicker, Dehydrierung von Ethylbenzol zu Styrol : Ein Beitrag zur Entwicklung eines Membranreaktorverfahrens, Mensch & Buch (ISBN 3-89820-177-5).
Voir aussi
Articles connexes
Liens externes
- Fiche toxicologique, INRS
- Fiche internationale de sécurité
 Portail de la chimie
Portail de la chimie