Forces de Debye

Pour les articles homonymes, voir Debye.
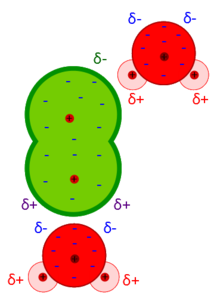
Les forces de Debye sont les forces intermoléculaires résultants de l'interaction entre un dipôle permanent et un dipôle induit. Les forces de Debye font partie des forces de Van der Waals où elles expriment l'effet d'induction. Deux cas peuvent être envisagés selon que le dipôle induit est produit dans une molécule polaire ou apolaire.
Dipôle induit
Tous les atomes et molécules sont polarisables ; cette polarisabilité résulte de la déformation du nuage électronique due à la présence d'un champ électrique. Ce champ électrique peut être externe ou généré par la molécule polaire. Le dipôle induit s'exprime alors comme :
où est la polarisabilité de la molécule.
Interaction dipôle permanent - dipôle induit
1. Molécule polaire (1) vs molécule apolaire (2).
Le potentiel d'interaction dépend du moment dipolaire de la molécule 1 ainsi que de la polarisabilité de 2.
2. Molécule polaire (1) vs molécule polaire (2).
Dans ce cas, il faut prendre en compte le fait que 1 créé un dipôle induit dans 2 et que simultanément 2 crée un dipôle induit dans 1. Le potentiel est alors de :
v · m Liaisons chimiques | |||||||
|---|---|---|---|---|---|---|---|
| Intramoléculaire (« forte ») |
| ||||||
| Intermoléculaire (« faible ») |
| ||||||
| Clivage | |||||||
 Portail de la chimie
Portail de la chimie  Portail de la physique
Portail de la physique


![{\displaystyle V=-{\frac {1}{r^{6}}}\left[{\frac {\mu _{1}^{2}\cdot \alpha _{2}}{(4\pi \cdot \epsilon _{0}\cdot \epsilon _{r})^{2}}}\right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/230fa05483e65dc056563e10613657840ff05023)
![{\displaystyle V=-{\frac {1}{r^{6}}}\left[{\frac {\mu _{1}^{2}\cdot \alpha _{2}+\mu _{2}^{2}\cdot \alpha _{1}}{(4\pi \cdot \epsilon _{0}\cdot \epsilon _{r})^{2}}}\right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c658e8ab9a3ba1f5b0ce1311f3fe34c73587471e)











