Catalyseur de Crabtree
| Catalyseur de Crabtree | ||
 | ||
 | ||
| Identification | ||
|---|---|---|
| Nom UICPA | hexafluoridophosphate(1−) de (SP-4)tris(cyclohexyl)phosphane [(1-2-η:5-6-η)-cycloocta-1,5-diène] pyridineiridium(1+) | |
| No CAS | 64536-78-3 | |
| No ECHA | 100.164.161 | |
| Propriétés chimiques | ||
| Formule | C31H50F6IrNP2 [Isomères] | |
| Masse molaire[1] | 804,89 ± 0,032 g/mol C 46,26 %, H 6,26 %, F 14,16 %, Ir 23,88 %, N 1,74 %, P 7,7 %, | |
| Unités du SI et CNTP, sauf indication contraire. | ||
modifier  | ||
Le catalyseur de Crabtree est un complexe de l'iridium, du cycloocta-1,5-diène (COD), de la tris-cyclohexylphosphine et de la pyridine. C'est un catalyseur homogène pour les réactions d'hydrogénation, développé par Robert H. Crabtree, professeur à Yale.
L'atome d'iridium a dans le complexe une géométrie plan carré, comme prévu pour un complexe d8[2],[3].
Crabtree et un de ses étudiants, George Morris, ont découvert ce catalyseur dans les années 1970 alors qu'il travaillait à l'Institut de chimie des substances naturelles de Gif-sur-Yvette sur un équivalent à base d'iridium du catalyseur de Wilkinson, un catalyseur à base de rhodium. L'un des avantages du catalyseur de Crabtree est qu'il est environ cent fois plus actif que celui de Wilkinson et peut même hydrogéner des alcènes tri et tétrasubstitués.
Le catalyseur de Crabtree a aussi été utilisé pour créer de nouveaux catalyseurs. En modifiant les ligands, il est possible de moduler les propriétés du catalyseur. Par exemple, l'utilisation de ligands chiraux a mené à la création de catalyseurs énantiosélectifs.
Comparaison avec d'autres catalyseurs
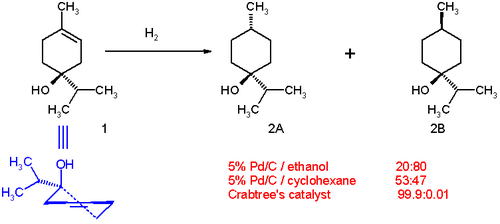
Pour l'hydrogénation de certains terpén-4-ol[4] :
- Avec du palladium sur carbone (Pd/C) dans l'éthanol, la produit de réaction est majoritairement l'isomère trans (proportion 20:80) (2B dans le schéma ci-dessous). Le côté polaire (celui avec le groupe hydroxyle) interagit avec le solvant laissant la surface apolaire se lier à la surface du catalyseur.
- Toujours avec du Pd/C dans le cyclohexane la proportion change pour un rapport 53:47 ; le côté polaire (le cyclohexane étant apolaire) a cette fois une faible préférence pour la surface du catalyseur.
- Avec l'utilisation du catalyseur de Crabtree dans le dichlorométhane, la proportion entre les produits s'inverse complètement en faveur de l'isomère cis (2A) (99,9:0,1). Cette orientation résulte de l'interaction entre le groupe hydroxyle et le centre iridium. De la même façon, les composés comportant des groupes carbonyles réagissent pareillement lors de l'hydrogénation avec un catalyseur de Crabtree.
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Crabtree's catalyst » (voir la liste des auteurs).
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- ↑ (en) Crabtree, R. H., « Iridium compounds in catalysis », Acc. Chem. Res, vol. 12, , p. 331–337 (DOI 10.1021/ar50141a005)
- ↑ (en) Brown, J. M., « Directed Homogeneous Hydrogenation », Angew. Chem. Int. Ed., vol. 26, , p. 190–203
- ↑ (en) Crabtree, R.H. Davis, M. W., « Directing effects in homogeneous hydrogenation with [Ir(cod)(PCy3)(py)]PF6 », J. Org. Chem., vol. 51, no 14, , p. 2655–2661 (DOI 10.1021/jo00364a007)
v · m | |||
|---|---|---|---|
| Ir(0) |
| ||
| Ir(I) |
| ||
| Ir(II) | |||
| Ir(III) |
| ||
| Ir(IV) |
| ||
| Ir(V) |
| ||
| Ir(VI) |
| ||
| Ir(VII) |
| ||
| Ir(VIII) |
| ||
 Portail de la chimie
Portail de la chimie










